

目前活体肿瘤实验室使用肾包膜下移植技术,已成功建立超过250 种可移植的 PDX 模型,广泛用于各种良恶性肿瘤的基础研究、转化研究以及个体化研究中。有研究报道从宫颈癌患者切除的肿瘤组织移植到NSG小鼠肾包膜中,发现存活率达到71.4%。通过SCID小鼠肾包膜下移植的前列腺癌PDX,其成功率高达95%。SRC移植方法增强了患者恶性肿瘤重要生物学特性的保留,包括组织病理学、分子特征、肿瘤异质性、转移能力和对治疗的反应。
(1)PDX模型在前列腺癌组织分型中的应用
在1991年至2005年期间,有研究分别从156例患者中收集了261个前列腺癌(Prostate cancer, PCa)样本,并将其皮下植入雄性SCID小鼠中,这些PDX模型被统一命名为LuCaP PDX,LuCaP系列基本涵盖了常见的PCa类型,其中从21个原位PCa组织中成功构建了4个局限性PCa的PDX模型,它们很好地验证了人类PCa的主要基因组和表型特征的改变,如雄激素受体的扩增、PTEN缺失、TP53缺失和突变、RB1丢失、TMPRSS2-ERG重排、SPOP突变等。另外LuCaP系列已成功建立了5种神经内分泌型(NEPC)PDX模型,其中LuCaP 49稳定增殖了4年,该模型来源于1例BII期PCa患者的转移性淋巴结,拥有更快的倍增时间,对雄激素剥夺治疗不敏感,缺乏AR和PSA但表达突触素、CD57等神经内分泌蛋白等特征。此外,源于前列腺尿道切除术的LuCaP 93、肝转移的LuCaP 145.1和LuCaP 173.1以及淋巴结转移的LuCaP 145.2等均表现出NEPC特征和相似的基因组特征。

图4 LuCaP PDXs和4个代表性H&E和IHC组织来源的LuCaP PDXs,其组织起源转移。采用石蜡包埋转移和皮下PDX肿瘤。PDXs维持原发转移灶的形态。在LuCaP PDXs中,AR、PSA、PTEN、ERG和SYP的表达(作为代表性标记)显示出总体上与起源组织一致,但LuCaP 86.2表达ERG和SYP,而起源转移为阴性。
(2)PDX模型在胰腺癌组织分型中的应用
胰腺导管腺癌(Pancreatic ductal adenocarcinoma, PDAC)是一种令人沮丧的疾病。大多数患者被诊断为晚期转移期,总体生存率较低。PDAC基因组分类中最具临床意义的亚型是不稳定基因组,最常见和明确的基因组改变是BRCA1和BRCA2基因的生殖系突变。缺乏BRCA1/2的细胞更倾向于DNA双链断裂(DSB)和染色体重排,导致基因组不稳定,增加恶性转化的易感性和同源重组缺陷(HRD)。构建BRCA PDX模型被用于BRCA相关的PDAC抗性治疗研究。例如PARPi联合放射增敏治疗。还可以用于BRCA相关的PDAC其他新型抗癌治疗方法开发。这些模型还可以进一步用于BRCA相关耐药肿瘤的其他新治疗方法开发,如PARPi联合细胞毒性化疗,ATR/ATM/CHK1/Wee1/CDK/DNA-PK/抑制剂或免疫治疗,PARG、CX5461和HSP90等新治疗靶点
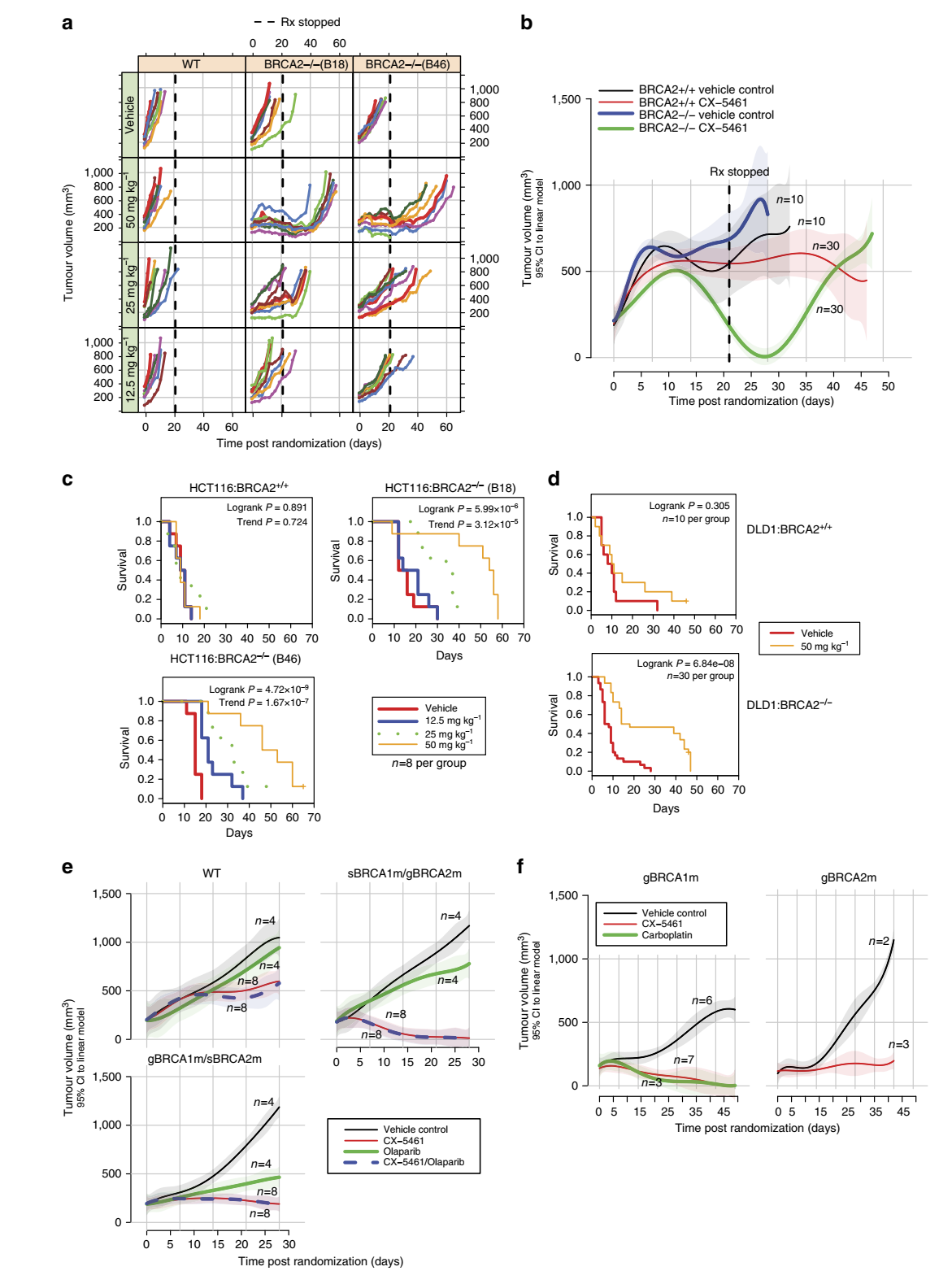
图5 CX-5461选择性抑制小鼠异种移植的化疗耐药BRCA缺陷的PDX模型中肿瘤的生长。(a, b) CX-5461对同基因WT和BRCA2敲除HCT116(a)和DLD1(b)细胞的异种移植肿瘤生长的影响。垂直虚线表示药物治疗结束。a中,每条彩色线代表单个老鼠。b中实线代表来自与肿瘤体积相匹配的线性模型的95% CI(实线周围的阴影)的平均肿瘤体积。(c, d)在HCT116细胞(c)和DLD1细胞(d)的异种移植瘤模型中,CX-5461的使用大大延长了有BRCA2缺陷肿瘤小鼠的生存期。(e)CX-5461对中紫杉耐药BRCA1/2缺陷的三阴乳腺癌(TNBC)PDX模型有效。移植自BRCA1和BRCA2 WT (CTG-1019)、BRCA1种系和BRCA2体细胞突变(CTG-0888, gBRCA1m/sBRCA2m)、BRCA2种系和BRCA1体细胞突变(CTG-0012, sBRCA1m/gBRCA2m)患者的肿瘤生长曲线。图中显示了95% CI(阴影区域)的肿瘤体积平均曲线。小鼠接受对照剂奥拉帕尼、CX-5461、奥拉帕尼和CX-5461联合治疗。(f)CX-5461对顺铂预处理BRCA1/2缺乏的TNBC PDX模型有效。图中显示了95% CI(阴影区域)的肿瘤体积平均曲线。肿瘤移植自BRCA1(CFIB-NB02)和BRCA2 (CFIB-70620)种系突变的患者。
(3)PDX模型在宫颈癌组织分型中的应用
有研究通过利用人宫颈癌细胞系HeLa、SiHa和CaSki和人脐静脉内皮细胞(HUVECs)构建一系列PDX小鼠模型,包括原发性鳞状细胞癌、原发性腺癌、复发性鳞状细胞癌和复发性腺癌模型,来评价四氧化二砷(TAO, As4O6)的抗癌作用。TAO在体内外实验中均显示出抗癌作用。
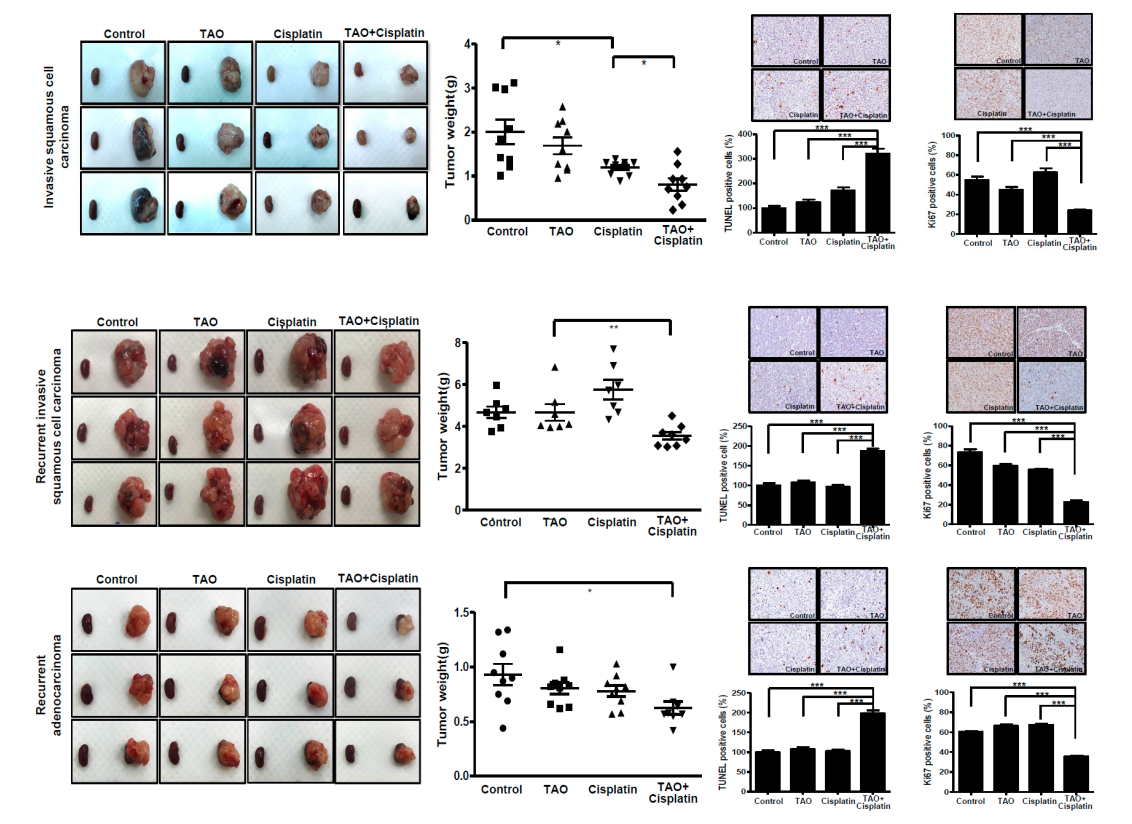
图6 小鼠PDX模型接受PBS、TAO、顺铂、TAO +顺铂后其移植瘤的改变。给予TAO+顺铂的小鼠模型中,原发性浸润性鳞状细胞癌、复发性浸润性鳞状细胞癌和腺癌的肿瘤重量显著降低。TUNEL实验和Ki-67实验结果也支持TAO联合顺铂在在原发性和复发性癌症模型中的协同作用。*p值< 0.05,**p值<0.01,***p值<0.001。
肿瘤转移机制是当前研究热点。一项研究将局限性PCa不同部位的组织切片制成不同的PDX模型,通过原位种植到小鼠前列腺中来测试每个亚系的转移能力,发现LTL-220N和LTL-221N亚系是非转移性的,而LTL-220M亚系在体内可自发转移,提示在局限性PCa 中只有少数癌细胞具有转移潜能。

图7 LTL-220M、LTL-220N和LTL-221N亚基具有不同的局部侵袭和转移能力。(A-C)苏木精和伊红(H&E)染色。(D-L)人特异性抗线粒体抗体免疫组化染色。第一列:当原位移植时,LTL-220M显示广泛侵犯宿主前列腺(A, D)和远处转移到宿主肺(G)和肝脏(J)。第二列和第三列:当原位移植时,LTL-220N和LTL-221N没有显示出明显的对宿主前列腺的侵袭和对远端器官的转移,包括肺(H)、脾(I)、肝(K)和肾(L)。
目前已经开发出多种高转移性PCa模型。LAPC-9是在长期去势环境中产生的适应性雄激素非依赖型PDX模型。BM18是应用较多的骨转移PDX模型,显示出PSA、AR和CK-18蛋白阳性并对雄激素敏感,且BM18对紫杉烷类化合物和多激酶抑制剂表现出较高的敏感性。利用LAPC-9(去势抵抗)和BM18(去势敏感)在不同激素水平下的差异进行分析,发现雄激素敏感性不同的转移性PCa PDX模型触发了不同的基质反应,并鉴定出具有50个基因的基质标记分子,这些基质标记分子与格里森评分、转移进展和无进展生存率等呈线性关系。
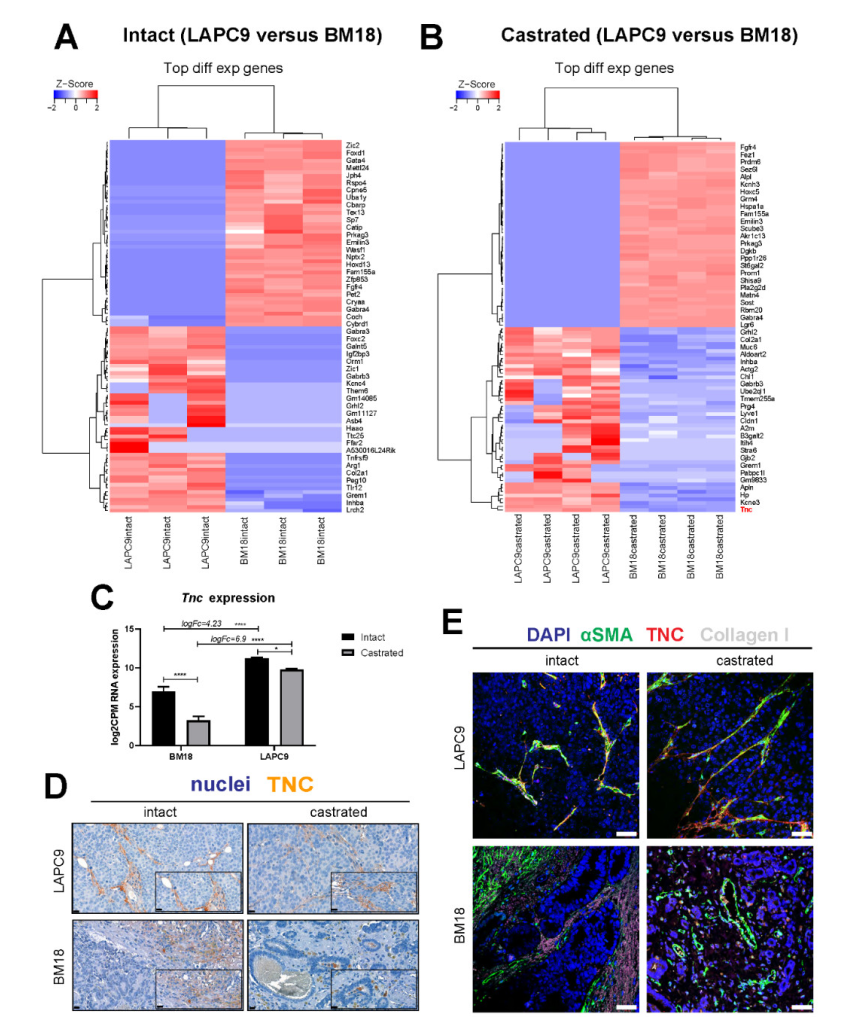
图8 LAPC9和BM18的交叉比较表明基质基因Tenascin C的表达与晚期前列腺癌相关,并受雄激素水平的调节。(A)Heatmap展示了小鼠转录组中,LAPC9完整肿瘤与BM18完整肿瘤比较差异最大的前100个基因的表达分析,以及(B)LAPC9阉割肿瘤与BM18阉割肿瘤的比较。(A)LAPC9样本中基因子集计数为零,导致相同的z-score,而BM18样本中相同的基因高表达。(C)Tnc RNA在基质转录组中表达(log2CMP计数)。Tnc LogFC (fold change)富集在LAPC9中高于BM18。p<0.05 (*) , p<0.0001 (****) 。(D)在完整和去势状态下,通过免疫组化评估了LAPC9和BM18肿瘤中Tenascin蛋白的表达和基质特异性。比例尺:20 μm。(E)在完整和阉割状态下,用免疫荧光法共定位检测LAPC9和BM18肿瘤的腱蛋白(红色)与基质标志物、平滑肌肌动蛋白(αSMA,绿色)和I型胶原(灰色)。比例尺:50 μm。
PDX模型已被证明是发现新的抗癌药物、临床前药物疗效测试和药敏、耐药研究的强大工具。有研究将PCa PDX模型中的肿瘤组织切片,在体外培养约6天后测试其对雄激素拮抗剂的敏感性,发现恩杂鲁胺可显著降低AR阳性肿瘤切片的增殖能力,促进细胞凋亡并降低了PSA的分泌,此结果与体内实验一致,提示这种离体组织切片拥有与本体一致的药敏特点,合理利用此模型可极大降低实验动物的数量和成本。
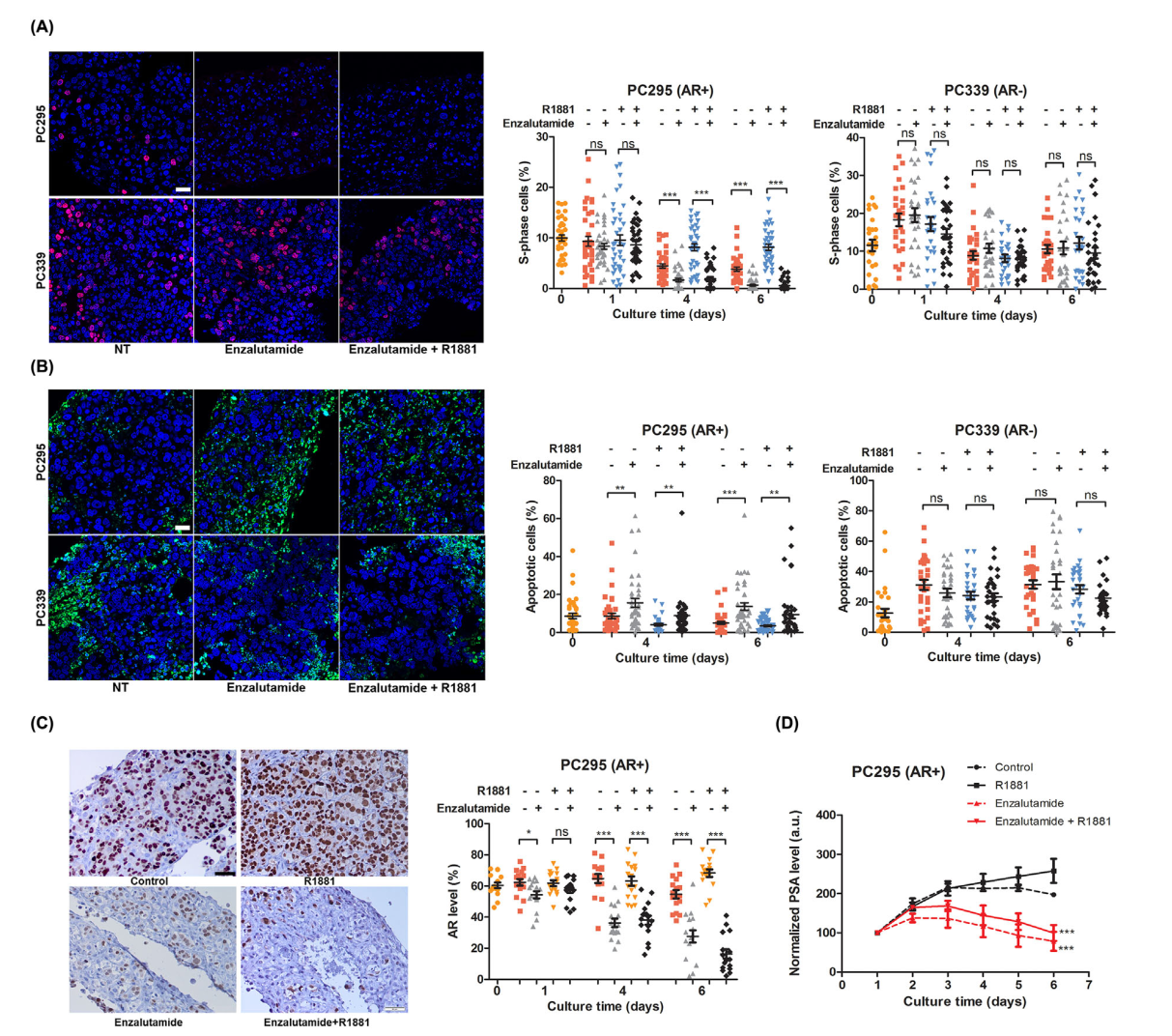
图9 体外治疗对恩杂鲁胺的反应。(A)在不同时间点PC295和PC339切片恩杂鲁胺阳性细胞数的定量。标尺100µm。(B)在不同时间点PC295和PC339切片TUNEL阳性细胞数的定量。标尺100µm。(C)第6天PC295组织切片AR染色的代表性图像和AR染色的定量。标尺50µm。(D)恩杂鲁胺处理和未处理的第1天至第6天PC295和PC339切片标准化累积PSA浓度。*** P<0.05, P<0.01, ***P< 0.001, ns不显著。
通常PDXs一旦在小鼠体内建立,就可以通过连续的移植来维持。连续移植的PDXs主要存在两个问题:(1)小鼠长期连续移植可能会促进遗传和表观遗传漂移,从而影响PDXs的生物保真度;(2)连续移植需要付出较高的经济成本和劳动力。因此,尝试冷冻保存异种移植物,并根据需要复苏,让组织重新生长是十分必要的。对于常规的皮下移植,冷冻标本的总体复苏率极低。我们使用肾包膜下移植方法从冷冻组织中复苏或恢复PDXs生长的成功率达到85%。因此,PDXs在早期可以以一种可复活的形式冷冻保存在实验室中,而SRC移植方法确保了模型的高生物保真度和重现性。